記事➡️海外治験情報をチェックするために、久しぶりに「Clinicaltrials.gov」を閲覧しました。
目的は、米国で取り組み中のGRN-1201のキイトルーダ併用治験(第Ⅱ相)の進捗に何か変化があるかどうかをかです。確認するためです。
結論から申し上げますと、特に新たな届け出はでていませんでした。
「Clinicaltrials.gov」➡️GRN-1201 With Pembrolizumab in Subjects With Metastatic PD-L1+ NSCLC - Full Text View - ClinicalTrials.gov
直近の会社説明会資料によると、ブライトパスのGRN-1201(非小細胞肺がん、キートルーダ併用)の第二相は、、、
治験参加者:64例
オープンラベル
サイモン二段階デザイン
そして、このClinicaltrials.govによると、、、
primary completion:2022年10月
study completion :2023年10月
とのこと。
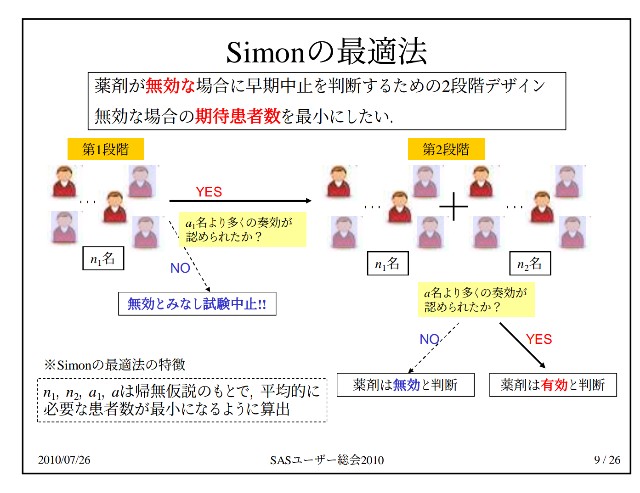
この「サイモン二段階デザイン」とは、どのようなものでしょうか?
一般的に、がん治験第Ⅱ相では、第Ⅰ相で決定された用法・用量に従い治験薬の効果および安全性を評価し、第Ⅲ相試験に進めるべきか否かを評価することが主目的となります。
エンドポイント(主要評価項目)は奏効率(腫瘍が一定以上に縮小した割合)が用いられ、オープンラベル(ダブルブラインドでなく、薬剤はオープンにされ医師も被験者も了解済み)で被験者全員が受ける単群試験が一般的です。
従って、Ⅱ相試験の目的は、臨床的な治療効果を検証することではなく、生物学的な抗腫瘍性の有無を示すことで後期過程へ進める薬剤をスクリーニングすることです。また、効果のない薬剤ならば中止できるよう、中間解析を伴うデザインが用いられます。
その代表的なものが、「サイモン二段階デザイン」です。
第一ステージで奏功例数が一定値を越えれば第二ステージに進み、そうでなければ、無効中止となります。
ブライトパスの会社説明会資料によると、第Ⅱ相の第1ステージは「2021年度以降」に矢印が付されています(以下ご参照)。
12月6日説明会の動画の永井社長のコメントを聞き直しても、21年度中なのかそれ以降なのかは、あまりはっきりとは触れていません。
この疑問はブライトパスに訊いてみます。
本治験はオープンラベルの治験であり、全ての被験者に薬剤が投与されますので、その効果は日々刻々と判明します。
ですから、治験の途中経過が著しく良好であれば(被験者のほとんどで腫瘍が縮小した、など)、メルクと機密保持契約(NDA)を結んでいれば、その情報をメルクに伝えて、前倒しのライセンスアウトも可能性としてはあります(これはあくまで楽観的なケースですが)。また、ライセンスアウト先はメルク以外も考えられます。
また、日本と米国とは治験の位置づけや承認の考え方が異なるので、、
例えば、昨年FDAに承認された「キートルーダ+化学療法剤2剤を併用する3剤併用療法」は、わずか123名の第Ⅱ相の結果によるものです。倫理的な良し悪しは別にして、米国の治験スパンと承認との関係は、日本とはかなり異なるのは事実です。
GRN-1201の治験(キイトルーダとの併用)は、ライバルも多く、研究開発のハードルも高いので、あまり大きな期待はしないのが得策かもしれません。
ただ、当たれば大ホームランですので、当てにせずに?待つことにしましょう。